| 제목 | [산업현황] 2023' FDA RMAT 지정 현황 |
|---|
| 분류 | 생명공학/바이오 | 판매자 | 김민성 | 조회수 | 49 | |
|---|---|---|---|---|---|---|
| 용량 | 310.44KB | 필요한 K-데이터 | 5도토리 |
| 파일 이름 | 용량 | 잔여일 | 잔여횟수 | 상태 | 다운로드 |
|---|---|---|---|---|---|
| 310.44KB | - | - | - | 다운로드 |
| 데이터날짜 : | 2023-12-29 |
|---|---|
| 출처 : | 국책연구원 |
| 페이지 수 : | 9 |
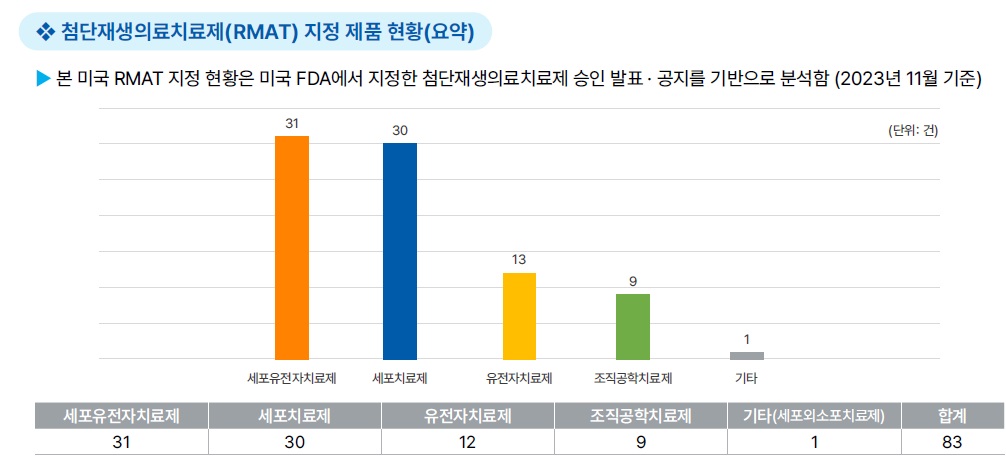
[첨단재생의료치료제(RMAT) 지정]
(관련법령) 「21세기 치유법」 SEC. 3033.
(목적) 미충족 의료 수요 질환 치료법 개발 촉진 및 환자 신속한 치료 기회 보장
(지정 대상) 세포치료, 조직공학치료, 인체세포와 조직제품, 치료법과 제품이 동시 사용된 복합제품
- FDA의 해석에 근거하여, 특정 인간 유전자치료제 및 이종 세포 제품도 RMAT에 포함될 수 있음
(지정 자격) ①지정 대상으로 정의되는 재생의료치료(RMT) 해당*, ②중증·생명 위협 질병, ③예비 임상 근거로 미충족 의료 해결
가능성 有
* Section 361 of the Public Health Service Act and part 1271 of Title 21, Code of Federal Regulations;
(지정 절차) RMAT 지정 요청은 임상시험용 신약 신청서(IND) 제출과 동시에 또는 기존 IND에 대한 수정으로 진행
- 지정 검토 중에 IND가 보류 중이거나 보류된 경우 RMAT 지정을 승인하지 않음
(관련 부서) 생물의약품평가연구센터(Center for Biologics Evaluation and Research, CBER) 內 치료제품국(Office of
Therapeutic Products, OTP) 담당
* 접수되는 IND 및 미팅 수가 ‘조직·첨단제제국(OTAT)’ 직원 수 증가를 초과함에 따라 세포 및 유전자치료제에 대한 심사 전문성 향상 및 직원 고용 증대를 위하여 ‘치료
제품국(OTP)’로 개편 시행(’22.9.)
-------------------------------------------------------------------------------------------------------------------------------------------------------
※ 본 서비스에서 제공되는 각 저작물의 저작권은 자료제공사에 있으며 각 저작물의 견해와 DATA 365와는 견해가 다를 수 있습니다.

