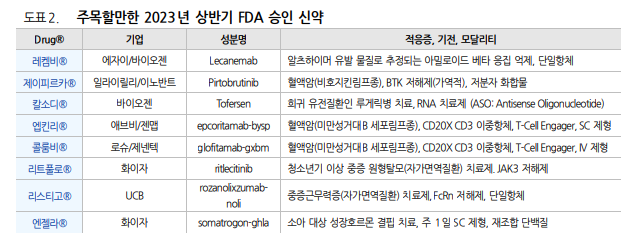
2023 년 상반기 FDA 승인 신약 27개 저분자 화합물 16개, 바이오의약품 11개(재조합 단백질, 단일항체, 이중항체, ASO 등) 알츠하이머 치료제, 혈액암 치료제, 레트 증후군, 루게릭병, 원형탈모 치료제, 지속형 성장호르몬 제제 등 승인 비만 치료제들의 임상 데이터 결과들 발표: 경구용 제제, 트리플 아고니스트 파이프라인 부각 하반기 주목해야 할 임상: 폐암치료제(임상명 MARIPOSA), 유전자치료제(EMBARK), 자가면역질환 치료제(GEMINI, EvolutionRMS1), 비만치료제(SELECT, NCT04707313) 등 임상 결과 발표 예정2023 년 상반기 FDA 승인 신약은 27 개로 2022 년 상반기 16 개 대비 크게 증 가하였다. 하반기에도 유사한 개수의 신약이 승인되어 2023 년에는 50 개 내외 의 신약이 FDA 승인을 받을 것으로 예상된다. 2022 년은 37 개에 그쳤다. 저분자화합물 16 개, 바이오의약품 11 개이며, 바이오의약품들은 모달리티별로 재조합단백질, 단일항체, 이중항체, ASO 등이 허가 받았다. CD20XCD3 타겟 이 중항체가 2 개나 승인받은 것이 주목할만하다. 빅파마 중 에자이, 일라이릴리, 바 이오젠, 애브비/젠맵, 로슈/제넨텍, 화이자 신약들이 승인받았다. 적응증 기준으로 분류하면 알츠하이머 치료제(레켐비®), 혈액암 치료제(제이피 르카®, 엡킨리®, 콜룸비®), 레트 증후군(데이부®), 루게릭병(칼소디®), 원형 탈모 치료제(리트풀로®), 지속형 성장호르몬 제제(엔젤라®), 중증근무력증 치료 제(리스티고®) 등이 승인받았다. 레켐비®는 오는 7 월 6 일 FDA 로부터 정식 승인을 받아 메디케어 등에서 급여 목록에 등재될 것으로 예상되나 진단 이슈, 안전성 이슈, 약가 이슈 등으로 처방 이 활성화되기까지는 많은 시간이 소요될 것으로 보인다. 판매사인 에자이도 레 켐비®의 매출 증가는 2025 년 이후로 예상하고 있다. 제이피르카®는 10 조원 이 넘는 BTK 저해제 시장에 처음으로 출시되는 가역적 저해제라는 점에서 주목 할만하다. 엡킨리®와 콜룸비®는 혈액암 DLBCL(미만성거대B세포림프종)치료를 위한 이중항체 기전의 면역항암제로 CAR-T 치료제와 시장에서 경쟁 치료법이다. 아제닉스의 비브가르트®에 이어 두번째 FcRn 저해제로 출시되는 리스티고®는 한올바이오파마의 파이프라인과 경쟁 약물이라는 점에서 지켜봐야 할 것이다