| 제목 | [산업분석] 바이오분야_마이크로바이옴 CDMO 동향 |
|---|
| 분류 | 생명공학/바이오 | 판매자 | 국준아 | 조회수 | 59 | |
|---|---|---|---|---|---|---|
| 용량 | 1.72MB | 필요한 K-데이터 | 5도토리 |
| 파일 이름 | 용량 | 잔여일 | 잔여횟수 | 상태 | 다운로드 |
|---|---|---|---|---|---|
| 1.72MB | - | - | - | 다운로드 |
| 데이터날짜 : | 2023-04-30 |
|---|---|
| 출처 : | 국책연구원 |
| 페이지 수 : | 6 |
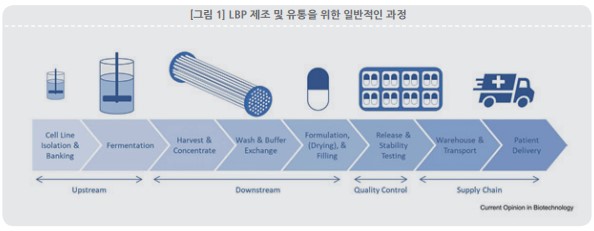
새로운 치료제 분야의 도전적인 측면 중 하나는 잘 정의된 규제 및 제조 프레임워크와 개발경 험이 부족하다는 것이다. 프로바이오틱스와 같은 마이크로바이옴 관련 제품은 의료 식품 또는 건강보조 식품으로 규제되었으며 GMP 제조는 관련 규정에 따라 수행된다. 그러나 이러한 제 품은 질병을 치료하는 약물로 평가되지 않았기 때문에 제조에서 GMP의 엄격함이나 제품 품 질 고려사항은 약물로 규제되는 LBP에 필요한 사항과 동일하지 않다. LBP 제조에는 업스트림설 구성 및 운영, 규제환경을 포함하여 전반에 걸쳐 고유한 고려사항이 필요하다. 박테리아의 고농도 대량 배양을 위한 분리, 발효 등의 업스트림과 세포의 농축, 완충액 교환, 세포 생존력 을 보존하기 위한 배합 등의 다운스트림 작업이 있으며 제품의 품질 특성을 최종적으로 준수 하는지 확인하는 QC와 제품 안정성, 세포 생존가능성을 유지하기 위해 환경조건을 제어하는 과정이 포함된다 및 다운스트림 바이오 프로세싱, 제제 개발, 품질관리 및 분석개발, 시일반적인 의약품 GMP는 최종 제품에서 미생물 제거를 지향하고 있으며 원칙적으로 오염없 는 제품을 보장해야 한다. 그러나, 박테리아 LBP 제제는 포장과 함께 생균 성분을 안정화하여 저장 및 투약기간 동안 생존력을 보존해야 한다. 미생물 제어 목적으로 약물 제형에 일반적으 로 사용되는 방부제 및 물리적인 조건은 성공적인 개발에 역효과를 낼 수 있다. 따라서 미생물 검사 및 균주식별은 LBP의 품질과 안전을 보장하기 위한 제어 전략의 중요한 부분이며 선택된 방법의 적합성과 테스트된 미생물의 작동 가능성을 입증할 책임이 있다.
※ 본 서비스에서 제공되는 각 저작물의 저작권은 자료제공사에 있으며 각 저작물의 견해와 DATA 365와는 견해가 다를 수 있습니다.

