| 제목 | [산업분석] 미국, 유럽의 바이오 의약품 인허가 절차 분석 |
|---|
| 분류 | 생명공학/바이오 | 판매자 | 나혜선 | 조회수 | 193 | |
|---|---|---|---|---|---|---|
| 용량 | 29.15MB | 필요한 K-데이터 | 9도토리 |
| 파일 이름 | 용량 | 잔여일 | 잔여횟수 | 상태 | 다운로드 |
|---|---|---|---|---|---|
| 29.15MB | - | - | - | 다운로드 |
| 데이터날짜 : | 2023-03-03 |
|---|---|
| 출처 : | 국책연구원 |
| 페이지 수 : | 73 |
[ 차례 ]
미국
01. 국가 일반 및 바이오의약품 산업 개요
02. 미국 (FDA)의 바이오의약품 분류
03. 바이오의약품 임상시험계획 신청 절차
04. 바이오의약품 품목허가 신청 절차
05. 바이오의약품 심속 심사 제도
유럽
01. 국가 일반 및 바이오의약품 산업 개요
02. 유럽 (EMA)의 바이오의약품 분류
03. 바이오의약품 임상시험계획 신청 절차
04. 바이오의약품 품목허가 신청 절차
05. 바이오의약품 심속 심사 제도
01 국가 일반 및 바이오의약품 산업 개요
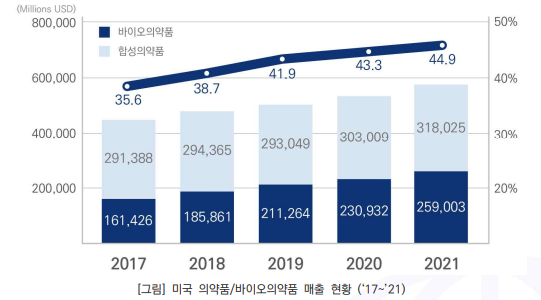
- 미국의 ‘21년 기준 바이오의약품 시장(매출 기준)은 약 2,590억 달러로, 의약품(전체) 대비44.9% 차지함
- 미국 바이오의약품 시장은 최근 5년(’17~‘21)간 연평균 13% 성장함
- 의약품(전체) 대비 바이오의약품 비중은 (’17년) 35.6% → (‘21) 44.9%로 증가함
※ 본 서비스에서 제공되는 각 저작물의 저작권은 자료제공사에 있으며 각 저작물의 견해와 DATA 365와는 견해가 다를 수 있습니다.

