| 제목 | [산업분석] 제약분야_유진 Biopharma Insight |
|---|
| 분류 | 생명공학/바이오 | 판매자 | 국준아 | 조회수 | 64 | |
|---|---|---|---|---|---|---|
| 용량 | 1.06MB | 필요한 K-데이터 | 3도토리 |
| 파일 이름 | 용량 | 잔여일 | 잔여횟수 | 상태 | 다운로드 |
|---|---|---|---|---|---|
| 1.06MB | - | - | - | 다운로드 |
| 데이터날짜 : | 2022-12-01 |
|---|---|
| 출처 : | 증권사 |
| 페이지 수 : | 8 |
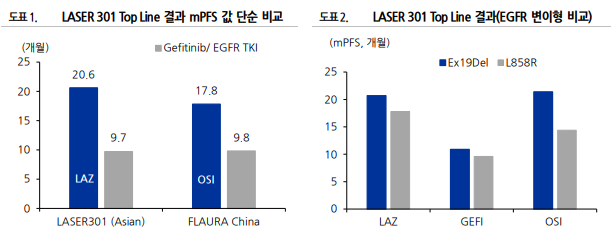
LASER 301 글로벌 임상 3 상 Top Line 결과 - 12 월 1 일 싱가폴 ESMO 학회(12.04~06)에서 발표될 유한양행(00100.KS, BUY, TP 80,000 원)/오스코텍의 레이저티닙(Lazertinib) 글로벌 임상 3 상(LASER 301, 단독요법/1차 치료제) Top Line 결과가 공시됨(임상 완료는 2024 년 6 월). 대조군(게피티닙 복용) 대비 사망위험을 55% 감소시켜 무진행 생존기간을 개선한 것으로 나타남. 특히 인종 및 EGFR 유전자형 변이에 따른 임상 결과값 차이가 크지 않았다는 점에서 경쟁약 타그리소 대비 우수한 데이터를 확보하였다고 판단됨 (1) mPFS (무진행 생존기간): 대조군 9.7 개월 대비 약 11 개월 증가한 20.6개월(비아시아인 NR)로 개선됨. DoR, ORR 도 개선 (2) mOS (전체 생존기간): 18 개월 시점 생존 비율 80%. HR (Hazard Ratio)=0.74 이나 통계적 유의성 없음(데이터 성숙도 29%) (3) 하위 그룹으로 아시아인 대상 임상 결과: 타그리소는 아시아인 대상으로 한 mPFS 는 17.8 개월임. 타그리소의 OS 결과 값은 아시 아인 대상으로 할 때 HR = 0.85로 표준요법 치료요법 대비 OS 개선의 유효성이 크지 않았음 (FLAURA China 임상 결과 참고) (4) EGFR 유전자형 변이에 따른 임상 결과값: 큰 차이를 보이지 않음. 타그리소는 EGFR 변이 중 L858R 변이 환자에 대해서 HR=1.0 을 보여 유전자형에 따라 치료 효과에 유의미한 차이가 있는 것으로 판단됨 (FLAURA China 임상 결과 참고) 향후 일정 update - 글로벌 단독요법 임상인 LASER 301 Top Line 결과를 근거로 1 차 치료제(Front Line Therapy) 시장 진입이 가능해질 전망. 2023년 1 분기에 국내에서 적응증 확대 신청이 예상되며, 2023 년 말경 국내에서는 1 차 치료제로 출시될 것으로 기대됨. 단독요법으로 글로 벌 신약 승인 신청은 논의 중인 것으로 파악됨. 당사는 2024 년에는 글로벌 판매(단독요법)도 가능할 것으로 기대함 - 존슨앤존스의 이중항체 신약 리브리반트와 병용요법 글로벌 임상인 ‘CHRYSALIS-2’ 및 ‘MARIPOSA-2’의 1 차 연구 완료 날짜는 2023 년 4 월과 5 월임. 그 결과를 토대로 2024년 하반기에는 병용요법으로도 글로벌 시장 출시가 가능할 전망. ‘MARIPOSA’(병용요 법, 타그리소와 직접 비교 임상) 결과는 2024 년 상반기 확인 가능하며, 병용요법으로 1 차 치료제 시장 진입은 2025년으로 기대함. 레이저티닙은 유한양행/오스코텍(039200.KQ, Not Rated)/제노스코가 공동 개발하여 2018 년 11 월 글로벌 제약사 존슨앤존슨에 기술 이전한 EGFR 변이 타겟의 3 세대 표적항암제. 비소세포폐암 치료제이며, 현재 국내에서 2 차 치료제로 허가 받아 판매 중
현재 진행되고 있는 레이저티닙(Lazertinib, 성분명)과 관련된 주요 글로벌 임상은 총 5 개(단독요법 1 개, 병용요법 4 개)임(도표 6,7,8,9). 가장 앞서 1 차 연구가 종료되는 글로벌 임상 ‘LASER 301’의 Primary Study Completion Date 는 2022 년 12 월로 이에 맞춰 금번 ESMO Singapore 2022 에서 Top Line 결과가 발표될 예정. 12 월 1 일에 공개된 Abstract 와 유한양행의 공시 자료를 분석한 결 과 예상대로(당사 7 월 18 일 자료 참고) 우수한 약효를 확인하였음. 동 임상 결과를 통해 단독요법 으로 1 차 치료제 시장 진입이 가능할 전망. 2023 년 1 분기 국내에서 적응증 확대를 위한 허가 변 경 신청이 진행될 예정이며, 2023 년 하반기 승인을 예상함. 이어서 EGFR 변이 비율이 높은 아시 아 시장을 먼저 공략할 것으로 예상됨. 단독요법으로 글로벌 판매는 2024 년 가능할 것으로 예상됨
※ 본 서비스에서 제공되는 각 저작물의 저작권은 자료제공사에 있으며 각 저작물의 견해와 DATA 365와는 견해가 다를 수 있습니다.

